环蕃(英文名,cyclophane)是指含有芳环和交叉连接的脂肪链(亦称ansa链)结构的分子。当芳香环上含有较大取代基且ansa链长度合适时,芳环平面围绕大环面的旋转受阻,其对称性发生破缺,从而产生平面手性。平面手性环蕃结构作为一类重要的有机分子骨架,广泛存在于众多具有显著生物活性的天然产物和药物分子中,在药物开发、主客体化学、不对称催化及材料科学等领域展现出重要的应用价值。目前,稳定的平面手性环蕃构型有如下几种途径:(1)芳环上引入大位阻基团(图1A,type I),(2)缩短ansa链的长度(图1A,type II),(3)ansa链上引入手性基团(图1A,type III)。其中,构型稳定的III型环蕃是众多生物活性分子(如天然产物Fijiolide A和药物Lorlatinib)的核心结构(图1B)。然而,现有合成III型环蕃的方法依赖于底物诱导的非对映选择性大环化反应,鲜有同时控制对映选择性、阻转选择性和非对映选择性的合成该类结构的报道。
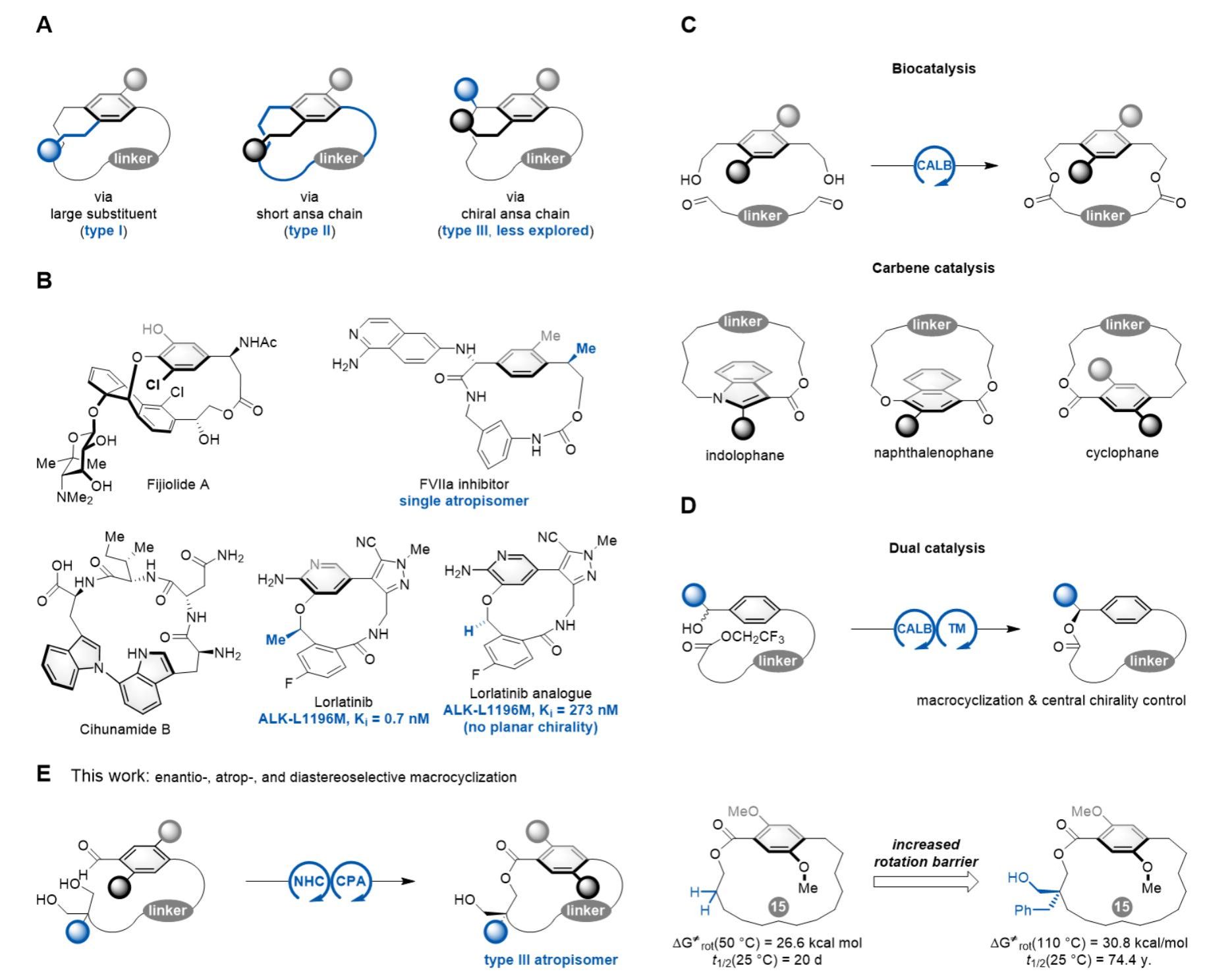
图1 研究背景介绍
近日,北京师范大学化学学院赵常贵课题组和我院刘涛教授、吕康副教授团队合作发展了氮杂环卡宾(NHC)和手性磷酸(CPA)协同催化的1,3-二醇去对称化策略,以对映选择性、阻转选择性和非对映选择性的大环内酯化反应构建III型环蕃(图1E)。该策略利用CPA与1,3-二醇形成的氢键作用稳定中间体构型,并通过NHC与底物形成的的非共价相互作用有效限制芳环的自由旋转并促进大环化过程,从而实现对平面手性和中心手性的控制。
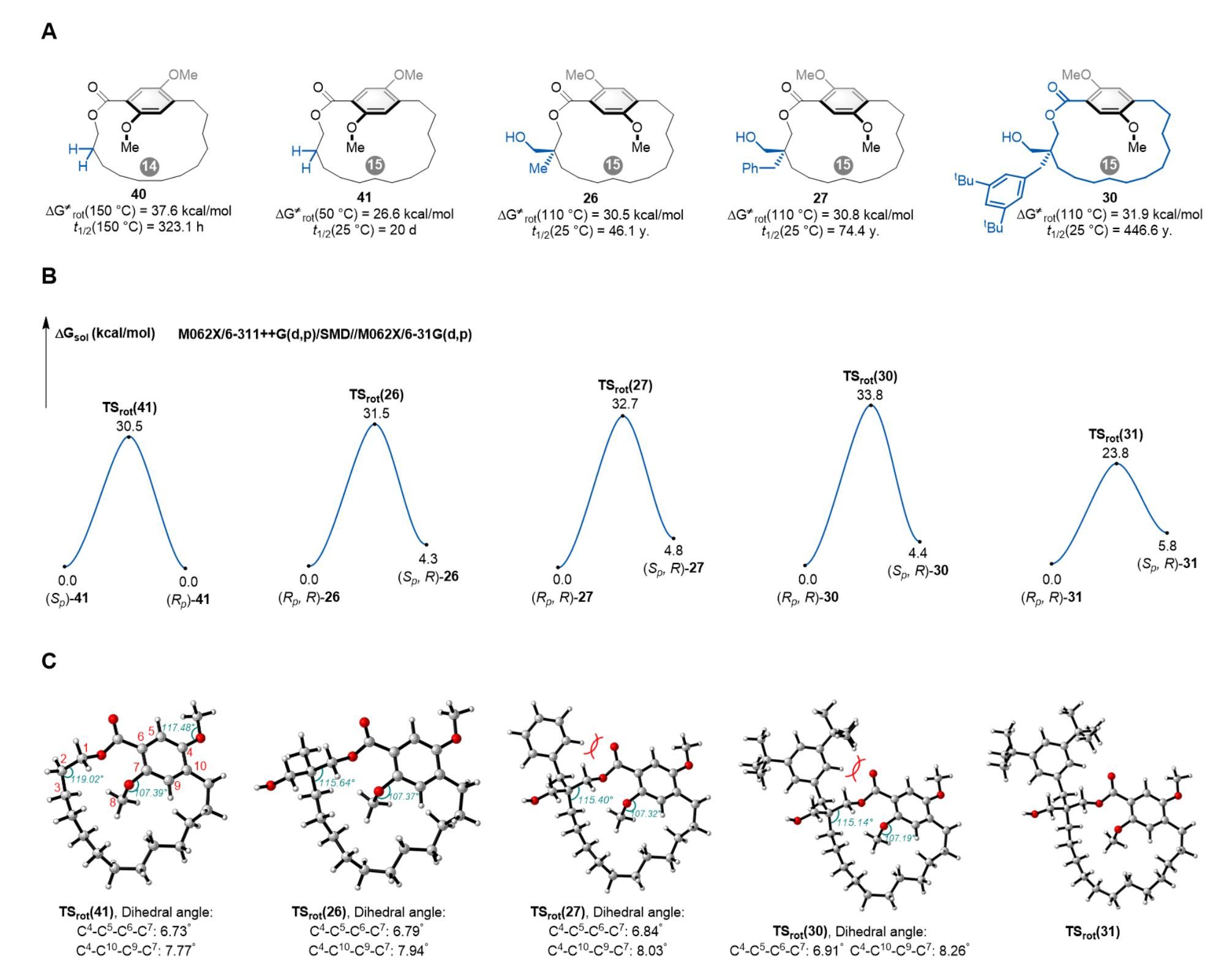
图2 平面手性环蕃构型稳定性及DFT理论计算
刘涛院长带领的理论计算团队对平面手性环蕃构型稳定性进行了DFT计算研究,揭示了ansa链上手性取代基稳定环蕃构型的作用机制。计算结果表明化合物43、26、27及30的过渡态的能垒呈现TSrot(43)<TSrot(26)<TSrot(27)<TSrot(30)的递增趋势(图2B),与实验结果高度吻合。对这些过渡态的几何结构分析显示,ansa链上手性取代基的存在会缩小C1−C2−C3键角,且取代基体积越大,键角缩减程度越显著(119.02° < 115.64° < 115.40° < 115.14°)(图2C)。键角减小导致ansa链整体缩短,从而抑制苯环的旋转过程。值得注意的是,C7−O−C8键角的扭曲以及C4−C5−C6−C7/C4−C10−C9−C7二面角的增大程度基本一致。此外,手性取代基与酯基间的空间位阻也可能是TSrot(27)与TSrot(30)能垒升高的原因。通过非共价相互作用分析,进一步证实了关键空间位阻排斥作用的存在。
相关成果以“Conformationally Defined Planar-Chiral [n]Paracyclophanes Stabilized by Chiral Ansa Chains”为题发表于《Nature Communications》杂志。北京师范大学硕士研究生王佳明、我院吕康副教授为论文的共同第一作者,刘涛教授和北京师范大学赵常贵副教授为共同通讯作者。
文章链接:https://www.nature.com/articles/s41467-025-58241-3